Bakteriellen Kollagenasen auf der Spur – Wie Bakterien menschliches Kollagen angreifen
Bakteriellen Kollagenasen auf der Spur – Wie Bakterien menschliches Kollagen angreifen
Bakterielle Kollagenasen spielen eine wichtige Rolle in der Virulenz bestimmter pathogener Bakterien der Familien Clostridium, Bacillus, Spirochaetes und Vibrio. Gleichzeitig werden sie auch in Industrie, Forschung und Kliniken nutzbringend angewendet. Trotz ihrer Bedeutung ist der genaue Mechanismus, wie diese Enzyme Kollagen abbauen, großteils noch ungeklärt.
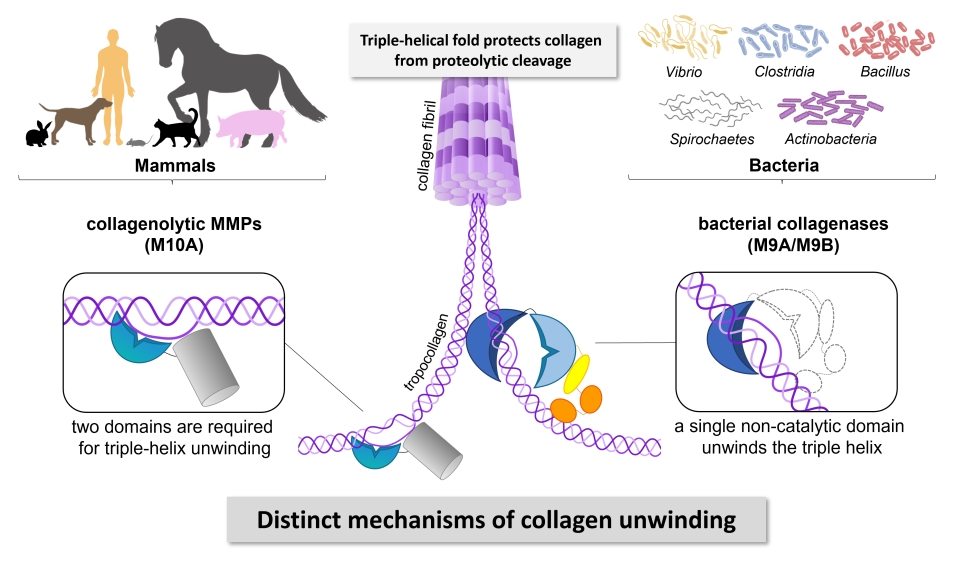
Wissenschaftler*innen unter der Leitung von Dr. Esther Schönauer am Fachbereich Biowissenschaften & Medizinische Biologie (PLUS) konnten anhand ihrer Forschung an der Kollagenase G (ColG) von Clostridium histolyticum zeigen, dass bakterielle Kollagenasen verschiedene physiologische Formen von Kollagen auf unterschiedliche Weise verarbeiten. Ob fibrilläres oder lösliches Kollagen, das Enzym passt sein Verhalten an die jeweilige Form an. Darüber hinaus haben die Forscher*innen u.a. mittels CD-Spektroskopie eine überraschende Entdeckung gemacht: Die als nicht-katalytisch angesehene Aktivatordomäne von ColG fungiert als die Tripelhelikase des Enzyms, d.h. sie entwindet (vorübergehend und lokal) Kollagenmoleküle.
Diese Erkenntnisse könnten weitreichende Auswirkungen haben. Kollagen ist entscheidend für die strukturelle Integrität aller Gewebe in Menschen und anderen Säugetieren. Bakterielle Kollagenasen besitzen die einzigartige Fähigkeit, Kollagen trotz seiner robusten Tripelhelix-Struktur an vielen Stellen anzugreifen und zu spalten. Dieses vom Österreichischen Wissenschaftsfond (FWF) geförderte Forschungsprojekt zeigt auf, wie sie diese Funktion erbringen, und enthüllt einen Mechanismus, der sich von dem menschlicher kollagenabbauender Enzyme klar unterscheidet. Diese Erkenntnis über die mechanistischen Feinheiten bakterieller Kollagenasen eröffnet neue Möglichkeiten für die Entwicklung gezielter Inhibitoren zur Bekämpfung bakterieller Infektionen. Indem die pathogen-spezifischen Mechanismen gestört werden, mit denen diese Enzyme Kollagen angreifen, wird der Weg für die Entwicklung wirksamerer Behandlungen gegen pathogene Bakterien geebnet.
Die Ergebnisse wurden im renommierten Fachjournal Proceedings of the National Academy of Sciences (PNAS) veröffentlicht:
Title: A conserved strategy to attack collagen: The activator domain in bacterial collagenases unwinds triple-helical collagen.
Abstract incl. Significance statement (Auszug aus PNAS):
Bacterial collagenases are important virulence factors, secreted by several pathogenic Clostridium, Bacillus, Spirochaetes and Vibrio species. Yet, the mechanism by which these enzymes cleave collagen is not well understood. Based on biochemical and mutational studies we reveal that collagenase G (ColG) from Hathewaya histolytica recognizes and processes collagen substrates differently depending on their nature (fibrillar vs. soluble collagen); distinct dynamic interactions between the activator and peptidase domain are required based on the substrate type. Using biochemical and circular dichroism studies, we identify the presumed non-catalytic activator domain as the single-domain triple helicase that unwinds collagen locally, transiently and reversibly.
Significance Statement
Collagens form the resilient backbone of the mammalian extracellular matrix. Only few proteases are able to digest collagen because of its tight triple-helical fold and high content of prolines and hydroxyprolines. Bacterial collagenases of the metalloprotease family M9 can efficiently degrade triple-helical collagen into small peptides. Yet, their mechanism of action is not well understood. We demonstrate that the activator domain of bacterial collagenases single-handedly unwinds collagen triple helices, enabling their subsequent cleavage by the peptidase domain. Our findings reveal that bacterial collagenases employ different mechanisms to recognize and unwind collagen than human collagenolytic MMPs. This discovery opens a new avenue for the development of highly selective inhibitors targeting bacterial collagenases.





