spaXio
Spatial Crosstalk in Immuno-Oncology
spaXio ist ein ehrgeiziges, von der EU gefördertes Doktorandennetzwerk (MSCA DN), das gemeinsam von Dr. Peter Krenn (Molecular Cancer Biology Lab) und Dr. Dirk Schmidt-Arras (Tumor Immunology Lab) an der Universität Salzburg, Österreich, koordiniert wird. Dieses internationale Konsortium vereint führende Forschungsgruppen aus ganz Europa, um die räumlichen und molekularen Mechanismen der Metastasierung zu entschlüsseln – also wie Krebszellen kommunizieren, sich metabolisch anpassen und ihre Mikroumgebung umgestalten, um entfernte Organe zu besiedeln.Durch 14 interdisziplinäre Doktoratsprojekte integriert spaXio modernste Krebsmodelle, räumliche Multi-Omics-Technologien und KI-gestützte Datenanalyse, um die zellulären und metabolischen Wechselwirkungen aufzudecken, die das Fortschreiten von Metastasen antreiben. Das Netzwerk bietet hervorragende Ausbildungs- und Kooperationsmöglichkeiten in Österreich, Deutschland, Frankreich, der Schweiz und Spanien. Weitere Informationen finden Sie unter
spaXio Projekt 3: Kartierung metabolischer und zellulärer Interaktionen in metastatischen Nischen von Darmkrebs
Betreuung: Peter Krenn (Molecular Cancer Research Lab, Salzburg)
Ko-Betreuung: Manfred Claassen (Tübingen), Spencer Watson (Lausanne)
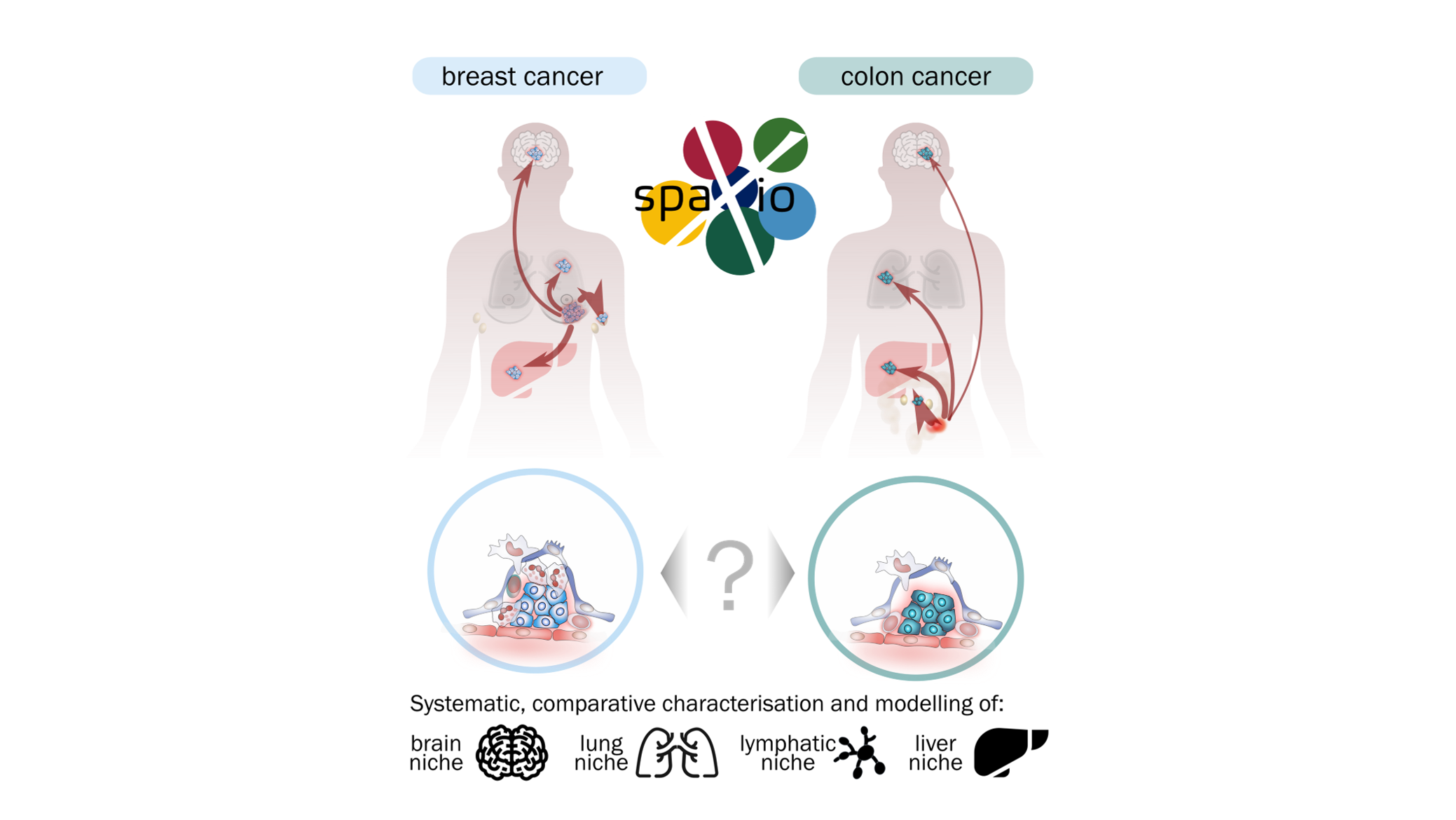
Metastasen – die Ausbreitung von Tumorzellen in entfernte Organe – sind die Hauptursache für krebsbedingte Todesfälle. Ihr Erfolg hängt nicht nur von den Eigenschaften der Tumorzellen selbst ab, sondern auch von ihrer Fähigkeit, das umgebende Gewebe zu einer unterstützenden „metastatischen Nische“ umzuprogrammieren. In diesem Projekt wird untersucht, wie metabolische Anpassungen und zelluläre Interaktionen innerhalb solcher Nischen das Schicksal disseminierter Tumorzellen und die Entstehung von Metastasen beeinflussen.
Die/der Doktorand*in wird die Bildung metastatischer Nischen anhand von modernen experimentellen Modellen erforschen, die genetische Manipulation, Organoid-Systeme und in vivo Metastasemodelle kombinieren. Dabei werden Kolon-Organoide und orthotope Transplantationsmodelle eingesetzt, um zu verstehen, wie Tumorzellen mit Stromazellen, Immunzellen und Endothelzellen interagieren. Die Organoide werden mithilfe von CRISPR/Cas9, Cre-LoxP-Rekombination und induzierten Onkogen-Expressionssystemen genetisch modifiziert, um Genfunktionen und onkogene Signalwege präzise räumlich und zeitlich zu steuern. So können zentrale Mechanismen der Tumor-Stroma-Kommunikation und des metabolischen Umbaus funktionell untersucht werden. Die metastatische Ausbreitung wird in vivo mittels luciferase-basierter Biolumineszenzbildgebung auf der AMI-Plattform verfolgt, um den Verlauf der Metastasierung nicht-invasiv und über längere Zeiträume zu erfassen. Zur Analyse der molekularen Architektur metastatischer Gewebe werden räumliche Transkriptomik (Xenium-Plattform), räumliche Metabolomik und multiplexe Immunfluoreszenz eingesetzt, um hochauflösende Karten von Genexpression, Stoffwechsel und Zellorganisation in Lymphknoten, Lunge, Gehirn und Leber zu erstellen. Aufbauend auf diesen Ergebnissen werden Kokulturen mit Stromal- oder Immunzelltypen etabliert, die als Schlüsselfaktoren der metastatischen Nische identifiziert wurden. Fluoreszenz- und konfokale Lebendzellmikroskopie wird vor bei Organoid- und Organoid-Kokulturen angewendet werden, um dynamische Zellinteraktionen, strukturelle Veränderungen und Reaktionen auf genetische oder metabolische Manipulationen sichtbar zu machen.
Durch die Kombination von genetischem Engineering, Live-Imaging und räumlicher Multi-Omik zielt das Projekt darauf ab, die Mechanismen zu entschlüsseln, mit denen Tumorzellen ihren Stoffwechsel und ihre Umgebung anpassen, um Metastasen zu bilden. Die Ergebnisse sollen neue therapeutisch angreifbare Signalwege identifizieren, die eine gezielte Störung der Metastasierung ermöglichen könnten. Dieses interdisziplinäre Doktoratsprojekt bietet umfassende Ausbildung in Organoid-Technologien, CRISPR/Cas9- und Cre-LoxP-Genmanipulation, Lebendzell- und Biolumineszenzbildgebung sowie räumlicher molekularer Profilierung, eingebettet in ein internationales, kollaboratives Forschungsumfeld.





