Forschung
Die heutige pharmazeutische Wirkstoffentwicklung konzentriert sich zunehmend auf komplexe, natürlich inspirierte, makromolekulare Wirkstoffe und Biologika wie therapeutische RNA, Proteine, Antikörper oder multifunktionelle Makromoleküle wie zB ‚targeted protein-degraders‘. Diese Substanzklassen revolutionieren den Prozess der Arzneimittelentwicklung, indem sie viele Orphan Targets und Indikationen medikamentös zugänglich machen. Aufgrund der meist unzureichenden Zell- und Gewebepenetration und der ungünstigen Biodistribution vieler dieser modernen Wirkstoffklassen besteht ein zunehmender Bedarf an effektiven, sicheren und gezielten Drug-Delivery-Technologien.
Exosomen sind natürlich vorkommende extrazelluläre Nanovesikel (EV), die von allen Zellen, in allen Königreichen des Lebens ausgeschieden werden. Sie spielen eine wesentliche Rolle in der zellulären Kommunikation und modulieren die Funktion ihrer Empfängerzellen durch funktionellen Transfer von Makromolekülen über Zell- und Gewebebarrieren hinweg. Im Gegensatz zu den meisten synthetischen Wirkstoff-vehikeln werden Exosomen von den Empfängerzellen durch ihre Filopodien aktiv rekrutiert und effektiv in Endosomen internalisiert, die in ihrer quantitativen Effektivität an die von Viren und anderen hochinfektiven Krankheitserregern herankommt (Heusermann W et al, JCB 2016). Innerhalb der Zellen shutteln sie als intakte Vesikel innerhalb von Endosomen, die in einer Stop-and-Go-Bewegung entlang des endoplasmatischen Retikulums scannen, bevor sie zum Abbau in das lysosomale Kompartiment geleitet werden.
Exosomen gelten als evolutionär optimierte, hochwirksame Nanotransporter von Makromolekülen über biologische Barrieren hinweg, die vom Spender- bis zum Empfängerzellenbereich gezielt eingesetzt werden und aus einem Repertoire von Proteinen, Lipiden und Nukleinsäuren bestehen, die vom dynamischen Zustand ihrer Mutterzellen abhängig sind. Ihre Biologie birgt daher ein immenses Potenzial für biomedizinische Anwendungen von der nicht-invasiven Diagnostik und leicht zugänglichen Biomarkern über zellfreie Zelltherapie bis hin zur biomimetischen Medikamentenverabreichung.
Eine Nutzbarmachung der EV Biologie für klinische Anwendungen und letztlich der Entwicklung neuartiger Pharmazeutika ist derzeit noch dadurch limitiert, dass die zugrunde liegenden molekularen, zellulären und physiologischen Mechanismen noch weitgehend unerforscht sind, sowie die verfügbaren analytischen Möglichkeiten zur Überwachung dieser heterogenen und komplexen biologischen Spezies noch unzureichend sind.
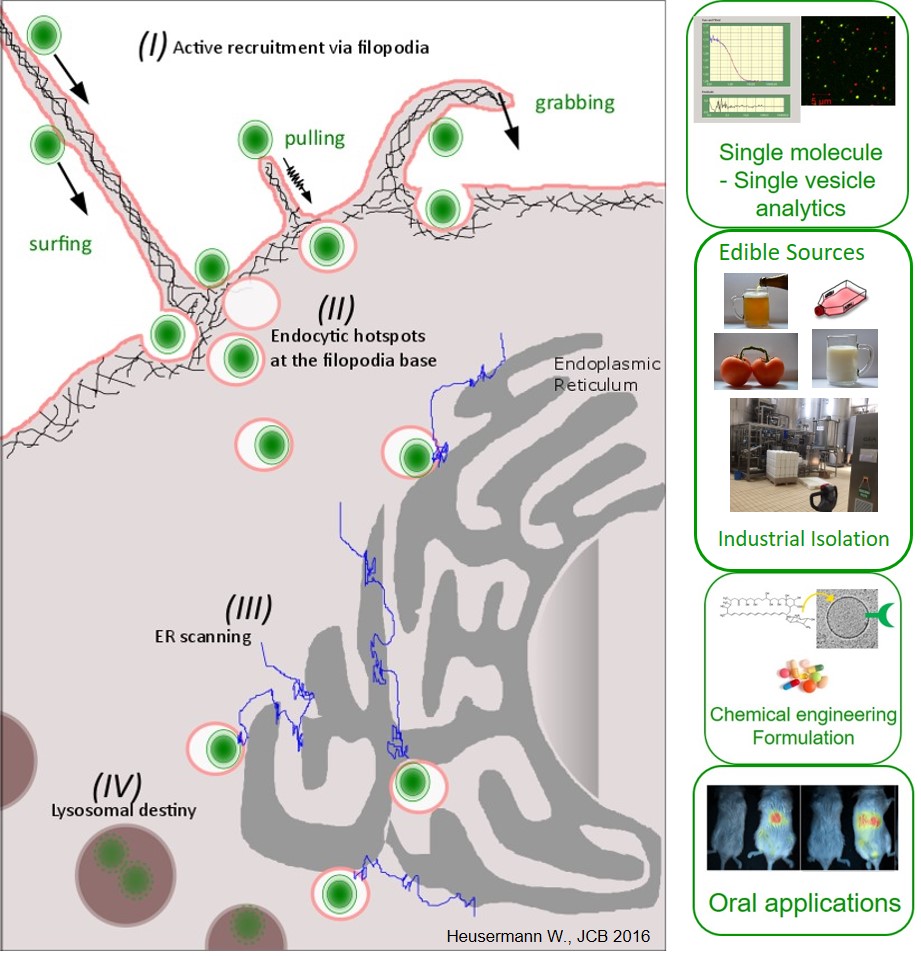
In unserer Gruppe konzentrieren wir uns auf:
- Aufklärung grundlegender Mechanismen der EV-Biogenese, des Transports und ihrer Wechselwirkungen mit Empfängerzellen durch quantitative molekulare Bildgebung und chemische Biologie
- Untersuchung von grundlegenden Mechanismen und Signalwege von Exosomen und Viren in deren Aufnahme, Transport und Metabolismus in Zielzellen
- Entwicklung von Analysemethoden zur Charakterisierung von extrazellulären Vesikel auf Einzelvesikel/Einzelmolekül-ebene
- Entwicklung neuer Strategien für die Gewinnung und Nutzbarmachung von (essbaren) EVs aus verschiedenen Quellen wie zB. Milchprodukten, Früchten und Eiern
- Entwicklung von Prototypen für EV-basierte orale Arzneimittelanwendungen
- Entwicklung von antiviralen Exosomen als therapeutische Platform für künftige Pandemien




