Funktionelle Studien zu extra-lysosomalem Legumain
FWF START Projekt #Y01469 | Projektleiterin: Elfriede Dall
Link zur Projektseite: Lysosomale Proteasen
Worum geht es?
Normalerweise kommt das Enzym Legumain im Endo-Lysosom unserer Zellen vor. Dort ist es ein wichtiger Akteur unseres Immunsystems. Es spaltet fremde Antigene wie z.B. Toxine in kleinere Peptide, damit diese von unserem Immunsystem erkannt werden können. Hauptsächlich unter pathophysiologischen Bedingungen wurde Legumain fehllokalisiert im Zytosol, im Zellkern oder extrazellulär gefunden. Obwohl die Fehllokalisierung von Legumain mit schweren Krankheiten wie Krebs und der Alzheimer-Krankheit in Verbindung gebracht wird, ist seine Funktion an diesen untypischen Orten noch immer nicht verstanden. Aufgrund seiner Relevanz bei einer Reihe sehr unterschiedlicher Erkrankungen wurde Legumain zu einem interessanten Target für die Arzneimittelentwicklung. Um sichere und effiziente Medikamente zu entwickeln, benötigen wir jedoch ein detailliertes Verständnis unseres Targets. Daher wollen wir in diesem Projekt die molekulare Funktion des verirrten, zytosolischen Legumain untersuchen.
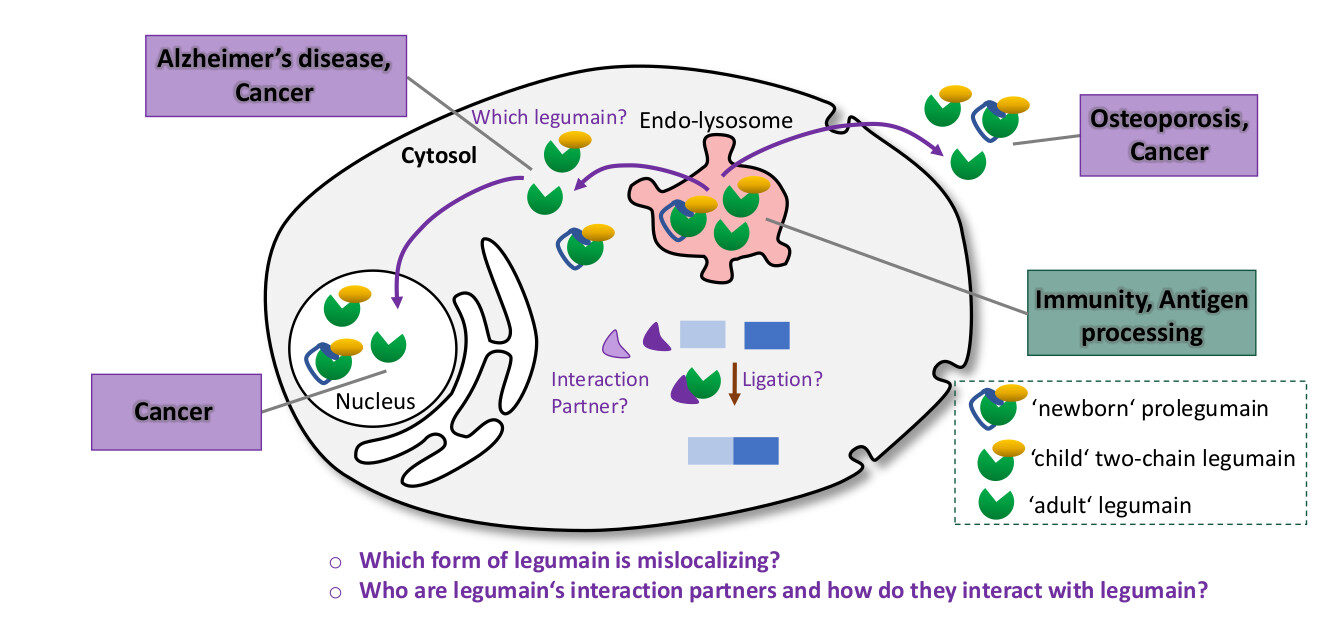
Abb. 1. Extra-lysosomales Legumain ist mit diversen Krankheiten assoziiert.
In einer früheren Studie fanden wir heraus, dass Legumain in drei unterschiedlichen Entwicklungsstufen existiert, die einer neugeborenen, einer kindlichen und einer erwachsenen Form entsprechen. Diese unterschiedlichen Formen des Legumain haben unterschiedliche Funktionen und unterschiedliche Eigenschaften. Während die erwachsene Form nur im sauren Endo-Lysosom überlebt, vertragen neugeborenes und kindliches Legumain auch einen neutralen pH-Wert, wie er im Zytosol zu finden ist. Darüber hinaus weisen die kindliche und die erwachsene Form des Legumain zusätzlich zu ihrer Protease-Funktion auch eine Ligase-Funktion auf. Sie können andere Proteine nicht nur schneiden, sondern auch verknüpfen. Wichtig dabei ist, dass Legumain die Ligasefunktion nur bei neutralem pH-Wert hat.
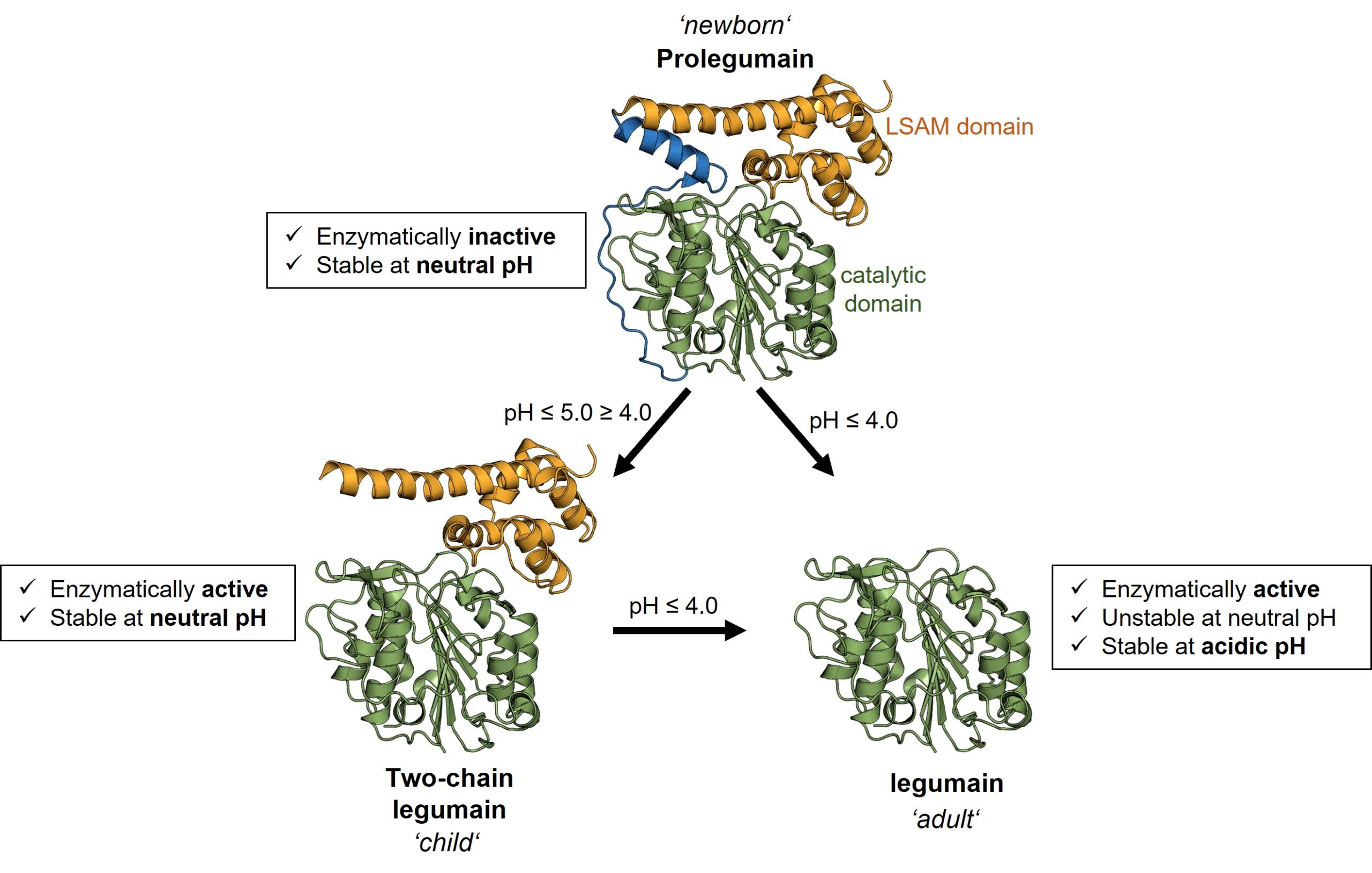
Abb. 2. Legumain existiert in 3 definierten Formen mit unterschiedlichen Funktionen und pH-Stabilitäten.
Basierend auf diesen Erkenntnissen stellen wir die Hypothesen auf, dass
- verschiedene Formen des Legumain umgebungsspezifische Funktionen haben,
- wenn die adulte Form des Legumain fehllokalisiert wird, sie durch einen Interaktionspartner stabilisiert werden muss und
- fehllokalisiertes Legumain seine pathophysiologische Funktion nicht nur durch Schneiden, sondern auch durch die Ligation anderer Proteine entfaltet.
Um diese Hypothesen zu testen, wollen wir eine Methode entwickeln, um die Ligasefunktion des Legumain in Echtzeit zu beobachten. Außerdem wollen wir identifizieren, welche Form des Legumain unter pathophysiologischen Bedingungen fehllokalisiert wird und wer seine Interaktionspartner sind. Dieses Wissen wird es uns ermöglichen, das Interaktionsnetzwerk fehllokalisierten Legumains zu enträtseln und in weiterer Folge neue therapeutische und diagnostische Werkzeuge zu entwickeln.




